Page 1 of 1
Orbitaler
Posted: 22/11-2016 16:53
by kjemiglad
Hei! Jeg sliter veldig med å forstå alt som har med skall og orbitaler å gjøre!
Jeg har en oppgave som lyder: "hvor mange SP^3 orbitaler finnes det i CH4 (metan) molekylet?"
Hvordan går jeg frem for å løse den?
Re: Orbitaler
Posted: 22/11-2016 17:03
by Kjemikern
kjemiglad wrote:Hei! Jeg sliter veldig med å forstå alt som har med skall og orbitaler å gjøre!
Jeg har en oppgave som lyder: "hvor mange SP^3 orbitaler finnes det i CH4 (metan) molekylet?"
Hvordan går jeg frem for å løse den?
Tegn opp stukturen og se på bindingene. Hvor mange s-orbitaler har du?, hvor mange p orbitaler deltar?
Re: Orbitaler
Posted: 22/11-2016 20:21
by kjemiglad
Kjemikern wrote:kjemiglad wrote:Hei! Jeg sliter veldig med å forstå alt som har med skall og orbitaler å gjøre!
Jeg har en oppgave som lyder: "hvor mange SP^3 orbitaler finnes det i CH4 (metan) molekylet?"
Hvordan går jeg frem for å løse den?
Tegn opp stukturen og se på bindingene. Hvor mange s-orbitaler har du?, hvor mange p orbitaler deltar?
Fire s-orbitaler totalt for hydrogen og to s-orbitaler totalt for karbon. I tillegg har karbon to P-orbitaler. (???). Dette ga egentlig ikke mening og jeg føler at jeg tenker på helt feil måte. Noen tips?
Re: Orbitaler
Posted: 22/11-2016 20:53
by Kjemikern
kjemiglad wrote:Kjemikern wrote:kjemiglad wrote:Hei! Jeg sliter veldig med å forstå alt som har med skall og orbitaler å gjøre!
Jeg har en oppgave som lyder: "hvor mange SP^3 orbitaler finnes det i CH4 (metan) molekylet?"
Hvordan går jeg frem for å løse den?
Tegn opp stukturen og se på bindingene. Hvor mange s-orbitaler har du?, hvor mange p orbitaler deltar?
Fire s-orbitaler totalt for hydrogen og to s-orbitaler totalt for karbon. I tillegg har karbon to P-orbitaler. (???). Dette ga egentlig ikke mening og jeg føler at jeg tenker på helt feil måte. Noen tips?
Vi begynner med orbitalene. Som du vet så har karbon 4 valenselektroner. Ettersom $1s$ skallet er fult. Videre så kommer elektronene fra hydrogenene og fyller opp de andre skallene. Da begynner vi på neste orbital. Det fylles først en i $2s$ orbitalen. Så vil elektronene fylles i hvert sitt p orbital. Som du vet så har vi $2p_x, 2p_y, 2p_z$. Her kommer et elektron inn hver, ergo fylles ett s skall og 3 p-skall, ergo $sp^3$. Det er mer termodynamisk gunstig for karbon å ha 4 bindinger enn 2.
Enkelt huske regel. Alle karbonatomer som har ENKELT bindinger er alltid $sp^3$ hybridtisert. Alle karbonsatomer drøm er å ha en valensvinkel på 109,5 grader, dette kommer av at da er H-atomene lengst fra hverandre.
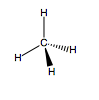
- Skjermbilde 2016-11-22 kl. 20.41.13.png (8.55 KiB) Viewed 4282 times
Re: Orbitaler
Posted: 23/11-2016 17:31
by Guest
Takk for svar! Vil det da si at det blir 4 sp^3-bindinger?
Vil det alltid være hybridbindinger når det er kovalente bindinger?
Re: Orbitaler
Posted: 23/11-2016 19:27
by Kjemikern
Gjest wrote:Takk for svar! Vil det da si at det blir 4 sp^3-bindinger?
Vil det alltid være hybridbindinger når det er kovalente bindinger?
Ja den har 4 $sp^3$ bindinger. Metan er $sp^3$ hybridtisert =)
Så lenge to orbitaler overlapper hverandre har du hybridbindinger.