Hei hei. Nå vet jeg ikke hvilket kurs du følger, men jeg skal prøve å gjøre det så enkelt så mulig.
Jeg skal prøve å illustrere det for deg. Er ikke den flinkeste til tegne i chemdraw, men det bør illustere poenget mitt ganske godt.
Slik du vet så er det enkeltbindinger i et alkan, hvor vi har en sigma binding, altså to sp^3 orbitaler som overlapper hverandre, se på figur 1.
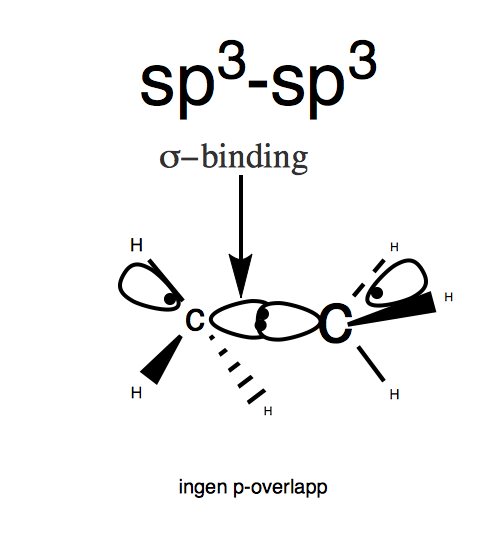
- Figur 1(etan)
- Skjermbilde 2016-02-17 kl. 11.34.40.png (38.84 KiB) Viewed 1942 times
((Stipla streker betyr at H-atomet peker bakover. Tjukk sterk betyr at den peker mot oss, og vanlige streker er den i planet. Er det vanskelig å illustrere, bruk et molekyl byggesett for å se)
Denne sigma bindingen er sterkere, og elektronene er bedre "skjermet", som gjør det vanskeligere for reaktanser for å få tilgang til dem. Med andre ord er etan relativ inert, fordi alle valens elektronene er knyttet opp i sterke, ikke-polare C-C og C-H bindinger, som sagt er den bedre skjermet og gjør det vanskeligere for reaktanser å ta dem(sigma-bindingen skjermer elektroene).
Derimot ser vi på orbitalene til et alken(eten, figur 2) ser vi noe annerledes.
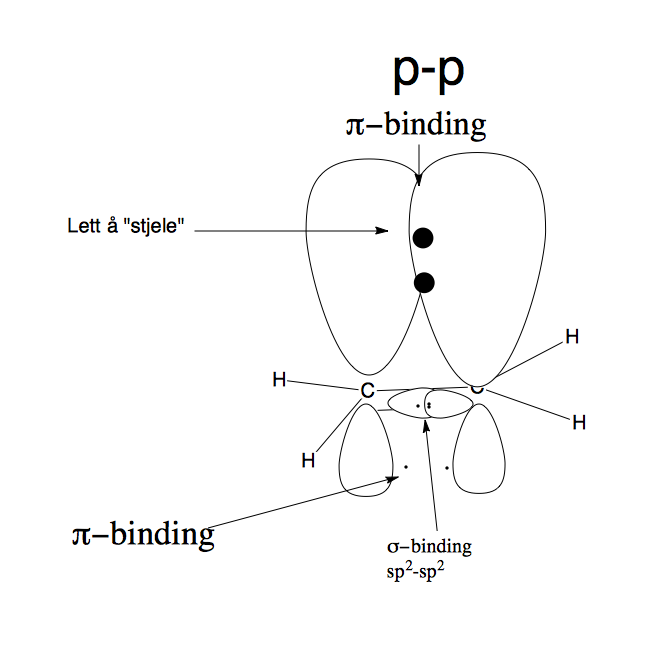
- Figur 2(eten)
- Skjermbilde 2016-02-17 kl. 11.32.35.png (53.78 KiB) Viewed 1942 times
Her derimot ser vi et C=C binding som er resultatet av to sp^2 hybridseret karbon atomer. Sigma bindingen her overlapper hverandre, i tillegg til at vi har p-p binding som også overlapper hverandre(pi-bindingen). Et viktig poeng å ta med seg er at dobbeltbindinger har et større elektrontetthet i enkeltbindingene(4 elektroner i en dobbeltbinding, mot to elektroner i en enkelbinding). Dette fører til at pi-bindingen er enklere å komme til for reaktanser som kommer, fordi de befinner seg i over planet i dobbeltbindingen, og istedenfor å bli skjermet av kjernen. Dette fører til at dobbeltbindingen er mer nuklofil som igjen fører til at alkener er dominert av reaksjoner med elektrofile.(eks. HBr)